(一)生物制品受理情况
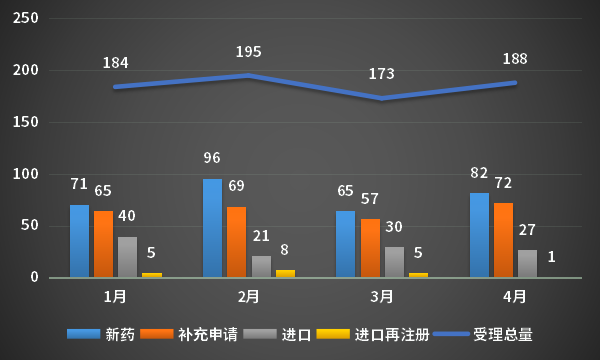
4月,CDE承办新的生物制品注册申请受理号共计188个,新药82个,补充申请72个,进口27个,进口再注册1个;2023年1-4月CDE生物制品各申请类型受理情况详见图8。
图8 2023年1-4月CDE生物制品各申请类型受理情况
1.生物制品1类新药申报情况
4月,共76个生物制品1类新药受理号获得承办,其中,临床试验申请71个,上市申请5个,目前均已进入相应序列排队待审;下表为4月新承办的生物制品1类创新药。
表6 2023年4月新承办的生物制品1类新药

(二)生物制品完成审评情况
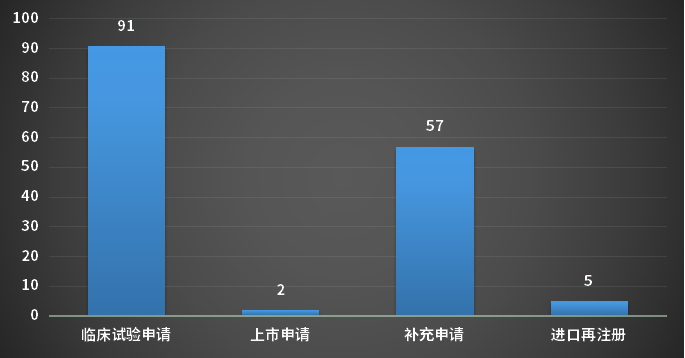
4月,CDE完成审评的生物制品注册申请165个(以受理号计),其中新药申请受理号81个,进口受理号12个,补充申请57个;以审评任务类别统计(以受理号计),临床试验申请91个,上市申请2个;2023年4月CDE生物制品各审评任务类别完成审评情况详见图9;
图9 2023年4月CDE生物制品各审评任务类别完成审评情况
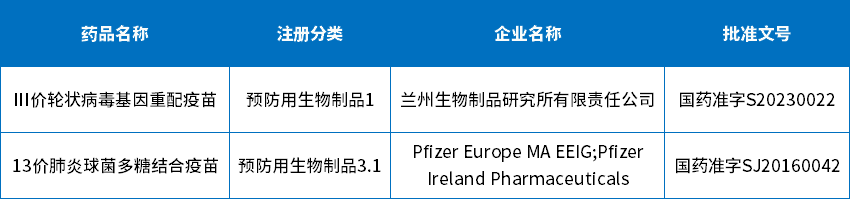
在受理号审评结论方面:批准临床112个,批准生产1个,批准进口1个,批准再注册5个,未被批准6个;4月份有1个预防用生物制品1类新药和1个3.1类预防用生物制品获批上市;下表为4月生物制品批准上市信息。
表7 2023年4月生物制品获批信息
(来源:药智网)