基因治疗的概念是在20世纪70年代初提出来的,最初的概念是引入一个正常的基因来取代一个突变基因,虽然现在有更多的替代方法,如基因编辑和碱基编辑,但它仍然是我们高度依赖的主要策略之一。
2012年欧洲批准Glybera,这是西方国家首个基因治疗产品,也是全球首个针对基因疾病的基因治疗。尽管Glylbera在商业上并不成功,但它打开了基因治疗的大门。在随后的几年里,一些基因治疗产品陆续涌入市场,Strimvelis于2016年在欧洲获得批准,CAR-T疗法(Kymriah和Yescarta)和Luxturna分别于2017年获得美国食品和药物管理局(FDA)的批准。
据弗若斯特沙利文数据显示,2015年以来,全球基因治疗行业开始高速发展。到2016年,全球和国内基因治疗市场规模分别为5,040万美元、1,500万元;2020年全球基因市场规模有所增长,达到20.8亿美元。据预计,2025年,全球市场和国内市场将分别达到近305.4亿美元和178.9亿元。基因治疗成为继小分子药物、抗体药物之后的生物医药的第三次产业革命。
基因治疗的发展阶段
基因治疗从发明到初步应用以及目前的蓬勃发展,经历了下面的四个阶段:
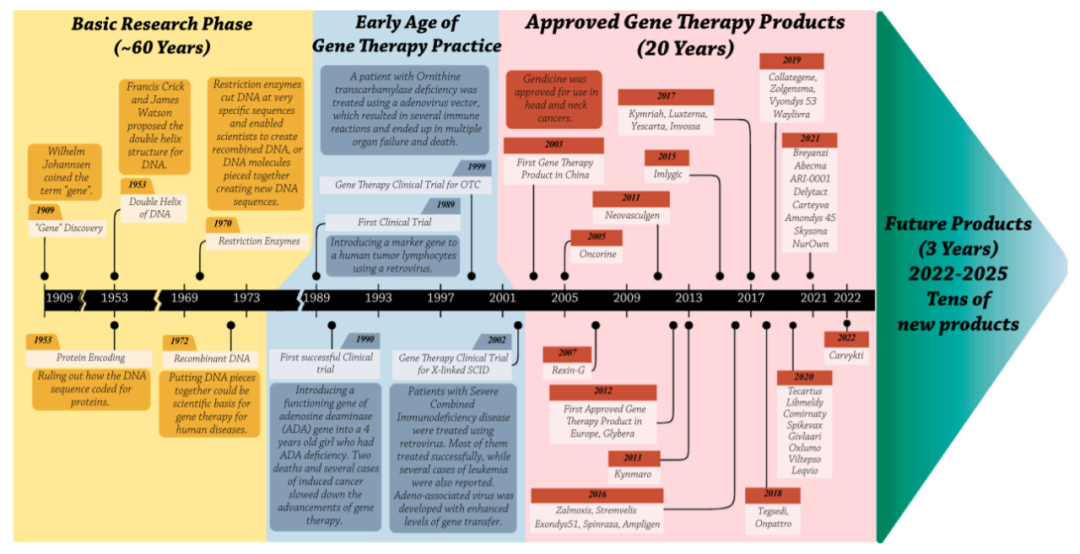
基础研究阶段(1909-1973)
最早,Wilhelm Johannsen创造了“基因”一词,然后在大约半个世纪后,Francis Crick和James Watson发现了DNA的双螺旋结构。细菌中基因转移的基本原理在20世纪60年代被发现,随后被发展为真核生物转染技术。到20世纪70年代,限制酶和连接酶的应用构成了基因操纵的基础,重组DNA技术使研究人员能够将选定的治疗基因引入工程载体。随着发现病毒转移遗传物质的能力,病毒载体已成为一种有前途的有效基因转移工具。这些技术进步使科学家能够创建将特定遗传物质转移到靶细胞中的基因治疗载体。
早期的基因治疗临床实践(1989–2003)
基因治疗的第一次临床实践开始于1989年,一种逆转录病毒被用于在肿瘤浸润淋巴细胞上表达新霉素抗性标记物,该标记物用于黑色素瘤免疫治疗中追踪浸润淋巴细胞。1990年,宾夕法尼亚大学的科学家对一名四岁的女孩Ashanti Desilva进行了第一次成功的基因治疗临床试验。她被诊断为严重联合免疫缺陷(SCID),研究人员使用逆转录病毒载体将腺苷脱氨酶(ADA)的正常拷贝转移到她的T细胞。目前她已经可以正常生活。
然而,病毒载体的使用伴随着一些不良事件,如插入突变和免疫反应,这阻碍了临床基因治疗的进展。2000年,巴黎的欧洲研究人员报告了一项X连锁SCID基因治疗的成功临床试验。然而,20名接受治疗的儿童中有5名在后期发展为白血病,这是因为在载体引入转基因后激活了一种癌基因。与此同时,1999年,Jesse Gelsinger,一名18岁的男孩,被诊断患有一种罕见的代谢性疾病,他自愿成为接受编码鸟氨酸转氨酶基因治疗的患者。然而不幸的是,其因大规模凝血障碍和随后的多器官衰竭而死亡,成为基因治疗的第一位死亡患者。尽管这些挫折减缓了基因治疗的进展,但它们也展示了基因治疗的潜力及其光明的未来。
繁荣发展阶段(2003-2022)
2003年,中国国家食品药品监督管理局(SFDA)批准了Gendicine,这是首款用于头颈部癌症的基因治疗产品。两年后,SFDA批准了Oncorine,这是第一种用于鼻咽癌的溶瘤病毒。十年后的2012年,欧洲药品管理局(EMA)批准了首个针对脂蛋白脂酶缺乏症的基因治疗产品Glybera,临床试验数量几乎翻了一番。
首个体外基因治疗产品Strimvelis于2016年获得EMA批准。2017年,FDA批准了两种嵌合抗原受体(CAR)T细胞产品Kymriah和Yescarta,这是为未来产品铺平道路的关键里程碑。Luxturna是FDA批准的首个用于Leber先天性黑蒙(LCA)的体内AAV基因治疗产品,并于2017年获得批准。2019年,FDA批准了迄今为止最昂贵的药物Zolgensma,这是一种AAV产品,适用于儿童脊髓性肌肉萎缩症。批准的基因治疗产品数量每年都在增加。
未来的发展(2022–2025)
根据之前的临床试验和目前批准的产品,这一前景广阔的医学领域似乎比以往任何时候都发展得更快,预计在不久的将来会有数十种新的产品获批。我们正在逐步将基因治疗纳入更广泛的疾病治疗领域。
(来源:医前沿)